- In:
- Posted By: Capuano Edoardo
- Commenti: 0
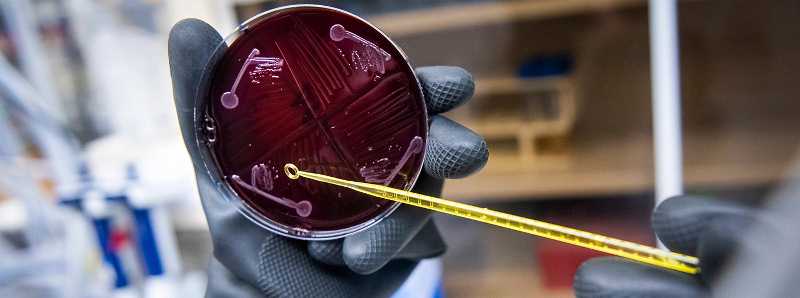
La comunità microbica di oltre 100 specie batteriche potrebbe aiutare gli scienziati a saperne di più sulle connessioni tra il microbioma e la salute umana
Studi chiave nell'ultimo decennio hanno dimostrato che il microbioma intestinale, la raccolta di centinaia di specie batteriche che vivono nel sistema digestivo umano, influenza lo sviluppo neurale, la risposta alle immunoterapie contro il cancro e altri aspetti della salute. Ma queste comunità sono complesse e senza metodi sistematici per studiare i costituenti, le cellule e le molecole esatte legate a determinate malattie rimangono un mistero.
I ricercatori della Stanford University hanno costruito il microbioma sintetico più complesso e ben definito, creando una comunità di oltre 100 specie batteriche che è stata trapiantata con successo nei topi. La possibilità di aggiungere, rimuovere e modificare singole specie consentirà agli scienziati di comprendere meglio i collegamenti tra il microbioma e la salute e, infine, di sviluppare terapie microbiome di prima classe.
Molti studi chiave sul microbioma sono stati condotti utilizzando trapianti fecali, che introducono l'intero microbioma naturale da un organismo all'altro. Mentre gli scienziati silenziano regolarmente un gene o rimuovono una proteina da una cellula specifica o anche da un intero topo, non esiste un tale insieme di strumenti per rimuovere o modificare una specie tra le centinaia in un dato campione fecale.
«Tanto di ciò che sappiamo sulla biologia, non lo sapremmo se non fosse per la capacità di manipolare sistemi biologici complessi a tratti», ha affermato il dottor Michael Fischbach (1), Institute Scholar presso Sarafan ChEM-H e autore corrispondente dello studio, pubblicato su Cell. (2)
Fischbach, che è professore associato di bioingegneria e di microbiologia e immunologia, e altri hanno visto una soluzione: costruire un microbioma da zero coltivando individualmente e quindi mescolando i suoi batteri costituenti.
Costruire l'arca
Ogni cellula del microbioma occupa una specifica nicchia funzionale, eseguendo reazioni che scompongono e accumulano molecole. Per costruire un microbioma, il team ha dovuto assicurarsi che la miscela finale non fosse solo stabile, mantenendo un equilibrio senza che nessuna singola specie prevalesse sul resto, ma anche funzionale, svolgendo tutte le azioni di un microbioma naturale e completo. Anche la selezione delle specie da includere nella loro comunità sintetica è stata difficile data la naturale variazione tra gli individui; due persone selezionate a caso condividono meno della metà dei loro geni microbici.
I ricercatori, incluso un team del Chan Zuckerberg Biohub, hanno deciso di costruire la loro colonia dai batteri più diffusi e si sono rivolti allo Human Microbiome Project (HMP), un'iniziativa del National Institutes of Health per sequenziare l'intero genoma microbico di oltre 300 adulti.
«Stavamo cercando l'Arca di Noè di specie batteriche nell'intestino umano, cercando di trovare quelle che erano quasi sempre presenti in ogni individuo», ha detto il professor Fischbach.
Hanno selezionato oltre 100 ceppi batterici che erano presenti in almeno il 20% degli individui HMP. L'aggiunta di alcune specie necessarie per alcuni studi successivi li ha portati a 104 specie, che sono cresciute in singoli ceppi e poi si sono mescolate in una cultura combinata per creare quella che chiamano comunità umana, o hCom1.
Sebbene soddisfatto che i ceppi potessero coesistere in laboratorio, il vero test era se la loro nuova colonia avrebbe messo radici nell'intestino. Hanno introdotto hCom1 nei topi che sono accuratamente progettati per non avere batteri presenti. hCom1 era notevolmente stabile, con il 98% delle specie costituenti che colonizzavano l'intestino di questi topi privi di germi e i livelli di abbondanza relativa di ciascuna specie rimanevano costanti per due mesi.
Invasione straniera
Per rendere la loro colonia più completa, i ricercatori volevano assicurarsi che tutte le funzioni vitali del microbioma fossero eseguite da una o più specie. Si basavano su una teoria chiamata resistenza alla colonizzazione, che spiega che qualsiasi batterio, quando viene introdotto in una colonia esistente, sopravvive solo se riesce a riempire una nicchia non già occupata.
Introducendo un microbioma completo, sotto forma di un campione fecale umano, nella loro colonia e tracciando qualsiasi nuova specie che si stabilisse, potrebbero costruire una comunità più completa.
Alcuni erano scettici sul fatto che questo avrebbe funzionato. «Le specie batteriche in hCom1 avevano convissuto solo per poche settimane», ha affermato Fischbach. «Eccoci qui, a presentare una comunità che coesisteva da un decennio. Alcune persone pensavano che avrebbero decimato la nostra colonia».
Sorprendentemente, hCom1 ha resistito e solo il 10% circa delle cellule nella comunità finale proveniva dal trapianto fecale.
Hanno trovato oltre 20 nuove specie batteriche che si sono inserite in almeno due dei tre studi sui trapianti fecali. L'aggiunta di quelli alla loro comunità iniziale e la rimozione di quelli che non riuscivano a mettere radici nelle viscere dei topi ha dato loro una nuova comunità di 119 ceppi, soprannominata hCom2. Questa seconda iterazione, ancora costituita dalla crescita individuale e quindi dalla miscelazione dei costituenti, ha reso i topi ancora più resistenti alle sfide fecali rispetto alla prima.
Sfida finale
Per dimostrare l'utilità del loro microbioma sintetico, il team ha preso topi colonizzati con hCom2 e li ha sfidati con un campione di E. coli. Questi topi, come quelli che sono stati colonizzati da un microbioma naturale, hanno resistito all'infezione.
Studi precedenti hanno dimostrato che un microbioma naturale sano porta alla protezione, ma Fischbach e colleghi potrebbero fare un ulteriore passo avanti eliminando o modificando in modo iterativo determinati ceppi per stabilire quali conferiscono protezione specifica. Hanno trovato diversi batteri chiave e hanno in programma di condurre ulteriori studi per restringere il campo alle specie più critiche.
Fischbach ritiene che hCom2, o le sue versioni future, consentiranno studi riduzionisti simili che rivelano gli agenti batterici coinvolti in altre aree, come le risposte all'immunoterapia.
«Abbiamo costruito questo consorzio per la più ampia comunità di ricerca. Vogliamo metterlo in più mani possibili per avere un impatto sul campo», ha affermato Fischbach.
Prevede inoltre che questo metodo di costruzione di un microbioma da zero renderà possibili in futuro terapie basate sul microbioma ingegnerizzato. In qualità di direttore della Stanford Microbiome Therapies Initiative (MITI) (3), un'iniziativa lanciata nel 2019 (4) da Sarafan ChEM-H e dal Dipartimento di Bioingegneria, mira a costruire comunità ingegnerizzate che potrebbero un giorno essere trapiantate nelle persone per curare o prevenire una varietà di malattie.
Michael Fischbach è un membro di Stanford Bio-X e della Wu Tsai Human Performance Alliance ed è un investigatore di Chan Zuckerberg Biohub. Altri autori di Stanford includono Alice Cheng, Po-Yi Ho, Andrés Aranda-Díaz, Feiqiao Yu, Xiandong Meng, Min Wang, Mikhail Iakiviak, Kazuki Nagashima, Aishan Zhao, Pallavi Murugkar, Advait Patil, Katayoon Atabakhsh, Allison Weakley, Ariel Brumbaugh, Steven Higginbottom, Alejandra Dimas, Anthony Shiver,Justin Sonnenburg e KC Huang.Il lavoro è stato sostenuto da una borsa di studio post-dottorato, dal National Institutes of Health, dal programma di ricerca scientifica sulla frontiera umana, dalla Fondazione Astellas per la ricerca sui disturbi metabolici, dalla Stanford Microbiome Therapies Initiative, dalla National Science Foundation, dalla Bill and Melinda Gates Foundation, la Helmsley Foundation, l'Howard Hughes Medical Institute, la Leducq Foundation, il Stanford-Coulter Translational Research Grants Program, MAC3 Impact Philanthropies e l'Allen Discovery Center di Stanford on Systems Modeling of Infection.
Riferimenti:
(2) Design, construction, and in vivo augmentation of a complex gut microbiome
(3) Microbiome Therapies Initiative (MITI)
(4) Stanford launches major effort to harness the microbiome to treat disease
Descrizione foto: Una coltura cellulare batterica dal laboratorio Fischbach. - Credit: L.A. Cicero.
Autore traduzione riassuntiva e adattamento linguistico: Edoardo Capuano / Articolo originale: Stanford researchers construct most complex, complete synthetic microbiome
