- In:
- Posted By: Capuano Edoardo
- Commenti: 0
Gli studiosi hanno compreso come l'eliminazione dei geni che codificano per le proteine TET (Ten-Eleven Translocation) può portare alla crescita del cancro.
Le diossigenasi TET (Ten-Eleven Translocation) effettuano la demetilazione del DNA attraverso la successiva ossidazione del gruppo metilico della 5-metilcitosina (5mC) nel DNA. Nell'uomo e nei modelli murini, la perdita di funzione del TET è stata collegata al danno del DNA, all'instabilità del genoma e all'oncogenesi.
Le mutazioni genetiche danno il via ai tumori. Alcune mutazioni rimescolano il codice genetico, altre derivano dalla cancellazione di geni chiave.
Al La Jolla Institute for Immunology (LJI) (1), i ricercatori hanno compiuto un importante passo avanti nella comprensione di come l'eliminazione dei geni che codificano per le proteine TET (Ten-Eleven Translocation) può portare alla crescita del cancro. Il loro nuovo studio, pubblicato su Nature Communications (2), è il primo a mostrare le conseguenze immediate dell'eliminazione di tutti e tre i geni dalla famiglia TET nelle cellule staminali embrionali di topo.
Utilizzando questo modello murino, i ricercatori hanno scoperto che le proteine TET sono fondamentali per mantenere il processo di replicazione cellulare e del DNA senza intoppi. Senza le proteine TET, i geni importanti scompaiono, portando alle mutazioni o alle aneuploidie (un-new-ploy-dees).
Le aneuploidie sono casi in cui il materiale genetico viene aggiunto o eliminato su vasta scala. Alle cellule con aneuploidie non manca solo un gene. Invece, i geni scompaiono attraverso un intero cromosoma. «Le aneuploidie sono una caratteristica comune delle cellule tumorali», afferma il ricercatore post-dottorato LJI Hugo Sepúlveda, Ph.D. (3).
La scoperta di questa connessione diretta tra la perdita di funzione del TET e le aneuploidie è un'importante scoperta nel campo della biologia cellulare e offre ai ricercatori un indizio su come trovare i geni che sostengono lo sviluppo del cancro. «Ora possiamo comprendere i meccanismi alla base dello sviluppo dell'aneuploidia, anche se non possiamo dire che questi cambiamenti avvengano sempre attraverso gli stessi geni in altri tipi di cellule», afferma il ricercatore post-dottorato LJI Hugo Sepúlveda, Ph.D.
Sepúlveda ha co-guidato la ricerca con l'ex ricercatore post-dottorato LJI Romain Georges, Ph.D., che ha generato il modello murino e derivato le cellule staminali per il progetto. La professoressa LJI Anjana Rao, Ph.D. (4), è l'autrice senior dello studio.
Cosa sono le proteine TET (Ten-Eleven Translocation)
Come ricercatrice ad Harvard, la dottoressa Rao ha scoperto la famiglia di proteine TET con Mamta Tahiliani, Ph.D., e L. Aravind, Ph.D. Il suo lavoro da allora ha dimostrato che le proteine TET sono attori chiave nella crescita e nello sviluppo cellulare. Le proteine TET possono proteggere dalle mutazioni che causano il cancro (5) e persino proteggere dall'infiammazione e dalle malattie cardiovascolari (6). Le proteine TET hanno un ruolo così importante nelle cellule perché influenzano la metilazione del DNA, un processo che altera il modo in cui il DNA viene letto e i geni vengono espressi.
Il lavoro della dottoressa Rao è stato particolarmente importante per comprendere la funzione TET nelle cellule immunitarie, come le cellule T, le cellule B e le cellule mieloidi. «La dottoressa Rao ha mostrato che ogni volta che si ha una delezione di un gene TET in queste cellule, si vede lo sviluppo di un diverso tipo aggressivo di cancro», afferma il dottor Hugo Sepúlveda.
Mentre questa ricerca continuava, il team del La Jolla Institute for Immunology (LJI) ha notato qualcosa di strano: anche le cellule con proteine TET mancanti o alterate tendono ad avere aneuploidie. Ecco un altro collegamento tra le proteine TET e il cancro.
Le cellule con perdita di funzione TET tendevano ad avere aneuploidie e le cellule tumorali tendevano ad avere aneuploidie.
Ma cosa viene prima?
La perdita di funzione del TET provoca aneuploidie e tumori o è il contrario?
Una scoperta emozionante
Per comprendere meglio il cancro, Georges e Sepúlveda si sono rivolti alle cellule staminali embrionali di topo come modello. Queste cellule erano naturalmente pronte a dividersi rapidamente ma non soggette a sviluppare tumori. I ricercatori avevano bisogno di vedere come l'eliminazione delle proteine TET potesse scuotere le cose.
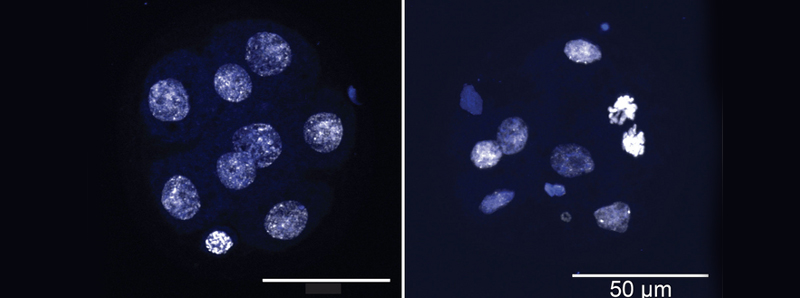
Più e più volte, Georges, Sepúlveda e i loro colleghi hanno scoperto che le cellule con delezione del TET sviluppavano aneuploidie a una velocità tre volte superiore a quella delle cellule normali. Queste cellule alterate hanno perso geni molto rapidamente e in modo casuale. Gli scienziati hanno potuto vedere gli effetti negli embrioni molto precoci, che consistevano di sole otto cellule.
«Ciò ha dimostrato che la cancellazione del TET ha avuto un effetto diretto sulle aneuploidie», afferma Sepúlveda. «È stato molto eccitante e non era stato mostrato prima».
Successivamente, i ricercatori si sono rivolti a una tecnica di sequenziamento chiamata RNA-seq per vedere come l'eliminazione del TET influenzi altri geni. Hanno visto una “sottoregolazione”, o spegnimento, di alcuni geni associati alla replicazione cellulare e del DNA. Questa scoperta ha suggerito che la cancellazione del TET è stato un duro colpo per un sistema che mantiene le cellule in divisione normalmente.
Quindi quali geni sono da biasimare?
La delezione di TET nelle cellule staminali embrionali di topo sembra avere l'effetto maggiore su un gene chiamato Khdc3, che apparteneva a un sistema, o complesso, che era stato precedentemente studiato per la sua attività nell'aiutare gli ovociti a dividersi. Questo complesso non è ben studiato, ma Khdc3 era noto per essere importante nel mantenere la stabilità del genoma negli ovociti prima e dopo la fecondazione e nelle prime fasi dello sviluppo embrionale.
Quando i ricercatori hanno ripristinato la funzione della proteina KHDC3 in queste cellule, sono rimasti sorpresi nel vedere che anche la stabilità del genoma è tornata. L'aneuploidia è stata invertita. Il complesso di cui Khdc3 fa parte è tornato a fare il suo lavoro.
Il nuovo studio ha rivelato due fatti chiave riguardanti la perdita di funzione del TET. In primo luogo, la perdita di funzione del TET è una causa diretta delle aneuploidie legate ai tumori, poiché ha comportato una diminuzione dell'espressione di Khdc3. In secondo luogo, la perdita di funzione del TET nelle cellule staminali embrionali influisce sulla stabilità del genoma attraverso un complesso contenente KHDC3.
Il dottor Sepúlveda fa attenzione a notare che il complesso Khdc3 è noto solo per essere attivo nello sviluppo embrionale precoce e nelle cellule staminali embrionali. Ciò significa che anche se si osservano aneuploidie nei tumori carenti di TET, gli scienziati devono ancora determinare se questi tumori sovraregolano il KHDC3 (la maggior parte dei tumori tende a sovraregolare i geni embrionali) e, in tal caso, se le aneuploidie che sviluppano sono causate da KHDC3 funzione aberrante.
In particolare, le aneuploidie sono osservate in numerosi tumori in cui i TET non sono mutati, ma questi tumori potrebbero aver perso la funzione TET a causa di disturbi metabolici.
«L'instabilità del genoma nelle cellule tumorali potrebbe verificarsi attraverso geni diversi da Khdc3, ma attraverso un meccanismo di regolamentazione simile che comporta anche cambiamenti sui modelli di metilazione del DNA», afferma Hugo Sepúlveda. «Se i tumori associati a TET sviluppino aneuploidie disregolando geni diversi rispetto a Khdc3 è ancora una questione aperta».
Andando avanti, Sepulveda spera di scoprire esattamente come il complesso Khdc3 promuove la stabilità del genoma a valle delle proteine TET nelle cellule staminali embrionali.
Altri autori dello studio, “Acute deletion of TET enzymes results in aneuploidy in mouse embryonic stem cells through decreased expression of Khdc3”, includono Carlos Angel, Eric Johnson, Susan Palomino, Roberta Nowak, Arshad Desai e Isaac F. López-Moyado.Questo lavoro è stato sostenuto dal National Institutes of Health (sovvenzioni R35 CA210043, R01 GM074215, NIH S10OD016262, NIH S10RR027366, AI125179 e F32 post-dottorato), dal Pew Latin-American Fellows Program di The Pew Charitable Trusts, University of California Institute per il Messico e gli Stati Uniti – Borsa di studio Consejo Nacional de Ciencia y Tecnología (UC MEXUS-CONACYT).
Questa ricerca ha utilizzato risorse dell'Advanced Light Source, che è un DOE Office of Science User Facility con contratto n. DE-AC02-05CH11231. NovaSeq 6000 e HiSeq 2500 sono stati acquisiti tramite il programma SIG (Shared Instrumentation Grant) (S10); NovaSeq 6000 S10OD025052 e HiSeq 2500 S10OD016262.
Riferimenti:
(1) Jolla Institute for Immunology
(3) Hugo Sepúlveda
(4) Anjana Rao
(5) Strange DNA structures may drive cancer development
(6) Hard-working enzyme keeps immune cells in line
Descrizione foto: L'immagine a sinistra mostra un blastomero a otto cellule sviluppato da cellule staminali embrionali di topo con normale funzione TET. L'immagine a destra mostra le conseguenze della cancellazione del TET (triplo knockout). Questo blastomero mostra segni di aneuploidie e difetti di segregazione cromosomica. - Credit: Per gentile concessione di Rao Lab, La Jolla Institute for Immunology.
Autore traduzione riassuntiva e adattamento linguistico: Edoardo Capuano / Articolo originale: On the trail of missing genes and cancer clues
