- In:
- Posted By: Capuano Edoardo
- Commenti: 0
La risposta immunitaria iniziale di un ospite gioca un ruolo fondamentale nel determinare se l'infezione si verifica e in che misura si diffonde all'interno di una popolazione.
I risultati, pubblicati su The American Naturalist, (1) forniscono informazioni preziose per comprendere e prevenire la trasmissione di malattie all'interno e tra le specie animali. Dai vermi piatti parassiti trasmessi dalle lumache all'uomo nei paesi in via di sviluppo, agli eventi di ricaduta zoonotica da mammiferi e insetti agli esseri umani - che hanno causato pandemie globali come COVID-19 e virus del Nilo occidentale - la risposta immunitaria di una creatura infetta è una variabile vitale da considerare nel calcolo di cosa succede dopo.
«Uno dei modelli più grandi che stiamo vedendo nell'ecologia e nell'epidemiologia delle malattie è il fatto che non tutti gli ospiti sono uguali», ha detto la dottoressa Tara Stewart Merrill, (2) autrice principale dell'articolo e borsista post-dottorato in ecologia. (3) «Nella ricerca sulle malattie infettive, vogliamo costruire l'immunità dell'ospite nella nostra comprensione di come si diffonde la malattia».
Gli invertebrati sono vettori comuni di malattie, il che significa che possono trasmettere agenti patogeni infettivi tra gli esseri umani o dagli animali agli esseri umani. Le malattie trasmesse da vettori, come la malaria, rappresentano quasi il 20% di tutte le malattie infettive (4) nel mondo e sono responsabili di oltre 700.000 decessi ogni anno.
Tuttavia, gli studi epidemiologici hanno raramente considerato l'immunità e il recupero degli invertebrati in creature che sono vettori di malattie umane. Presumono che una volta esposto a un agente patogeno, l'ospite invertebrato verrà infettato.
Ma se fosse possibile per gli invertebrati combattere queste malattie e spezzare l'anello della catena che le trasmette all'uomo?
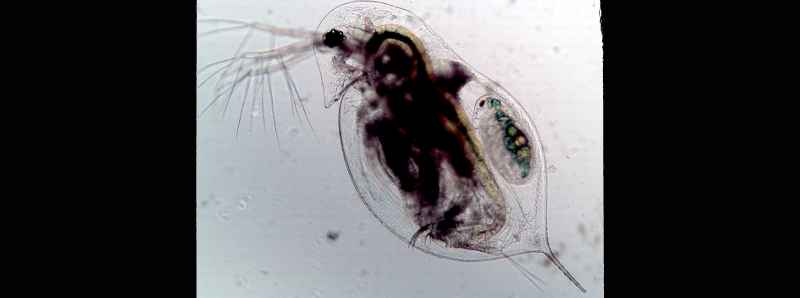
Durante l'osservazione di una minuscola specie di zooplancton (Daphnia dentifera) durante il suo ciclo di vita e l'esposizione a un parassita fungino (Metschnikowia bicuspidata), i ricercatori hanno visto questo potenziale in azione. Alcuni plancton sono riusciti a impedire alle spore fungine di entrare nei loro corpi e altri hanno eliminato l'infezione entro un periodo di tempo limitato dopo aver ingerito le spore.
«I nostri risultati mostrano che ci sono diverse difese che gli invertebrati possono utilizzare per ridurre la probabilità di infezione e che abbiamo davvero bisogno di comprendere quelle difese immunitarie per capire i modelli di infezione», ha detto Tara Stewart Merrill.
Recupero inaspettato
La dottoressa Stewart Merrill ha iniziato questo lavoro nel suo primo anno come studentessa di dottorato presso l'Università dell'Illinois, studiando questo piccolo plancton e la sua collezione di difese. È un processo raccapricciante se il plancton non riesce a scongiurare il parassita: le sue spore fungine attaccano l'intestino del plancton, riempiono il suo corpo e crescono fino a quando non vengono rilasciate nel momento in cui l'ospite alla fine muore.
Ma notò qualcosa che non era stato registrato prima: parte del plancton condannato si era ripreso. Diversi anni dopo, ha scoperto che di fronte a livelli identici di esposizione, il successo o il fallimento di queste infezioni dipende dalla forza delle difese interne dell'ospite durante questa prima finestra di opportunità limitata.
Sulla base delle loro osservazioni di questi risultati individuali, i ricercatori hanno sviluppato un semplice modello probabilistico per misurare l'immunità dell'ospite che può essere applicato a tutti i sistemi della fauna selvatica, con importanti applicazioni per le malattie trasmesse agli esseri umani dagli invertebrati.
«Quando le risposte immunitarie sono buone, agiscono come un filtro che riduce la trasmissione», ha detto la dottoressa Tara Stewart Merrill. «Ma qualsiasi cambiamento ambientale che degrada l'immunità può effettivamente amplificare la trasmissione, perché lascerà passare tutta quella esposizione e alla fine diventerà contagiosa».
È un modello che può essere applicato anche a COVID-19, poiché la ricerca di CU Boulder ha dimostrato che non tutti gli host sono gli stessi nella trasmissione del coronavirus (5) e l'esposizione non determina direttamente l'infezione.
«Si ritiene che COVID-19 sia anche il risultato di uno spillover zoonotico, un'infezione che si è trasferita dagli animali alle persone, e modelli probabilistici simili potrebbero essere vantaggiosi nel prevedere il verificarsi e la diffusione di futuri eventi di spillover», ha detto Tara Stewart Merrill.
Comprendere la prevenzione delle infezioni
La dottoressa Tara Stewart Merrill spera che una migliore comprensione delle infezioni in un animale semplice come il plancton possa essere applicata in modo più ampio agli invertebrati importanti per la salute umana.
In Africa, nel sud-est asiatico, così come nell'America meridionale e centrale, 200 milioni di persone soffrono di infezioni causate da schistosomi, invertebrati più comunemente noti come vermi piatti parassiti. Causano malattie e morte e significative conseguenze economiche e per la salute pubblica tanto che l'Organizzazione Mondiale della Sanità le considera le seconde malattie parassitarie socioeconomiche più devastanti dopo la malaria.
Sono solo una delle tante malattie tropicali trascurate trasmesse alle persone da ospiti invertebrati come lumache, zanzare e mosche pungenti. Queste malattie infettano gran parte della popolazione, ma si verificano in aree con bassi livelli di igiene che non dispongono delle risorse economiche per affrontare tali patologie, ha affermato Tara Stewart Merrill.
Gli schistosomi vivono in ambienti di acqua dolce che le persone usano per l'acqua potabile, il bucato e il bagno. Quindi, anche se ci sono trattamenti, il giorno successivo una persona può essere facilmente reinfettata solo accedendo all'acqua di cui ha bisogno. Comprendendo meglio come i vermi piatti stessi soccombono o combattono l'infezione, scienziati come Tara Stewart Merrill ci aiutano ad avvicinarci all'arresto della catena di trasmissione negli esseri umani. (6)
La ricercatrice aggiunge: «Abbiamo davvero bisogno di lavorare per comprendere la prevenzione delle infezioni e qual è il rischio in quei sistemi acquatici, piuttosto che solo le cure per l'infezione».
La buona notizia è che possiamo imparare dagli stessi invertebrati che ci infettano. Negli ospiti invertebrati che soffrono o muoiono a causa delle loro infezioni, c'è un buon incentivo per imparare a costruire una risposta immunitaria e combatterla. Alcune lumache hanno persino dimostrato la capacità di conservare una memoria immunologica: se vengono infettate una volta e sopravvivono, potrebbero non essere più infettate.
«Se riusciamo a capire meglio come l'ambiente modella queste difese, potremmo prevedere in futuro come i cambiamenti ambientali potrebbero amplificare o sopprimere il rischio di trasmissione alle persone», conclude la ricercatrice.
Riferimenti:
(1) Host controls of within-host disease dynamics: insight from an invertebrate system
(3) Tara Stewart Merrill - Johnson Laboratory
(5) 2% of people carry 90% of COVID-19 virus, and roommates are safer than you think
Descrizione foto: Uno zooplancton (Daphnia dentifera) infettato dal parassita fungino Metschnikowia bicuspidate. Le microscopiche spore fungine che riempiono il corpo sono visibili come macchie nere sfocate. - Credit: Tara Stewart Merrill.
Autore traduzione riassuntiva e adattamento linguistico: Edoardo Capuano / Articolo originale: How plankton hold secrets to preventing pandemics
